Gezielte Optogenetik
Subzelluläre Kontrolle der cAMP-Mikrodomänen-Signalübertragung in Kardiomyozyten durch gezielte Optogenetik
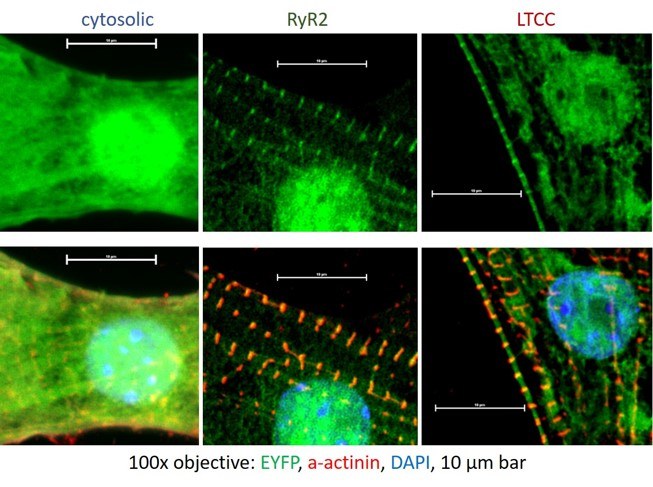
In Kardiomyozyten erhöht die cAMP/PKA-abhängige Phosphorylierung von L-Typ-Ca2+-Kanälen (LTCC) und Ryanodin-Rezeptoren Typ 2 (RyR2) die kontraktile Kraft, aber aufgrund der engen Nachbarschaft beider Proteine ist unklar, ob ihre cAMP/PKA-Mikrodomänen funktionell getrennt sind oder miteinander kommunizieren. Um die Unterschiede durch selektive Phosphorylierung zu untersuchen, erzeugen wir in diesem Projekt cAMP-Mikrodomänen von LTCC und RyR2 mit Hilfe eines neuartigen optogenetischen Ansatzes, bei dem die photoaktivierte Adenylatzyklase aus Turneriella parva (TpPAC) subzellulär gesteuert wird. TpPAC kann durch Fusion mit dem hochaffinen Protein FKBP12.6 auf die RyR2 und durch Fusion mit einem spezifischen Nanokörper auf die LTCC ß-Untereinheit ausgerichtet werden. Wir konnten einen Anstieg des diastolischen Ca2+ durch cAMP in RyR2-Mikrodomänen feststellen, was auf ein PKA-abhängiges Ca2+-Leck aus dem sarkoplasmatischen Retikulum hinweist und für das Verständnis der Mechanismen von Herzrhythmusstörungen von Bedeutung sein könnte.