AG Sasse
Die aktuelle Forschung von Prof. Sasse befasst sich mit neuen Methoden zur Diagnose und Therapie von Herzrhythmusstörungen: Mittels optogenetischer Verfahren, bei denen licht-sensitive Proteine in Herzzellen eingebracht werden, untersucht die Arbeitsgruppe Sasse die Entstehungsmechanismen von Herzrhythmusstörungen und testet die mögliche klinische Anwendbarkeit eines optischen Herzschrittmachers oder Defibrillators.
Prof. Dr. med. Philipp Sasse
Institut für Physiologie I
Nussallee 11
53115 Bonn
Forschung

Die AG Sasse zeigte 2010 das Potenzial der Optogenetik im Herzen in vivo und hat seitdem mit wichtigen Veröffentlichungen zur optogenetischen Manipulation von Signalkaskaden und der optogenetischen Defibrillation und Kardioversion dazu beigetragen, das Feld der kardialen Optogenetik voranzubringen. Mit neuartigen optogenetischen Werkzeugen und mechanistischen Erkenntnissen über Herzrhythmusstörungen will die Gruppe ein Wirkstoffscreening für pro- und anti-arrhythmische Effekte entwickeln und neue therapeutische Konzepte zur Beendigung von Herzrhythmusstörungen vorschlagen. Zur Untersuchung genetisch-bedingter Herzrhythmusstörungen verwendet die Arbeitsgruppe Sasse auch induzierte pluripotente Stammzellen, die aus Hautbiopsien gewonnen und zu Herzmuskelzellen differenziert werden können, und konnte erstmals zeigen, dass damit das »Lange QT Syndrom 3« in der Kulturschale untersucht werden kann. Die Forschung der Arbeitsgruppe Sasse ist zwar überwiegend grundlagenorientiert, wird jedoch auch in Teilen zur Identifizierung neuer klinischer Anwendungen für die Therapie von Herzrhythmusstörungen genutzt.
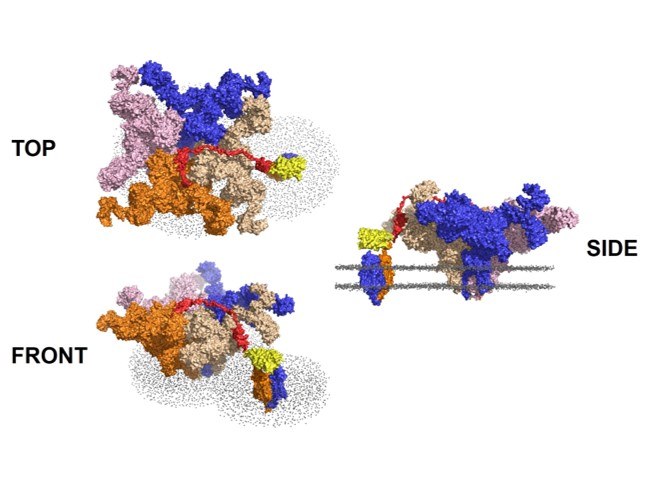
OptoRyR2
Optogenetik ermöglicht die Ca2+-Freisetzung aus den intrazellulären Speichern über den kardialen Ryanodin-Rezeptor

Optogenetische Adrenerge Stimulation
Optogenetische Stimulation der Gs-Signalkaskade erhöht die Auslösung von ventrikulären Arrhythmien aus dem Endokard und moduliert die Aufrechterhaltung und Komplexität von Arrhythmien
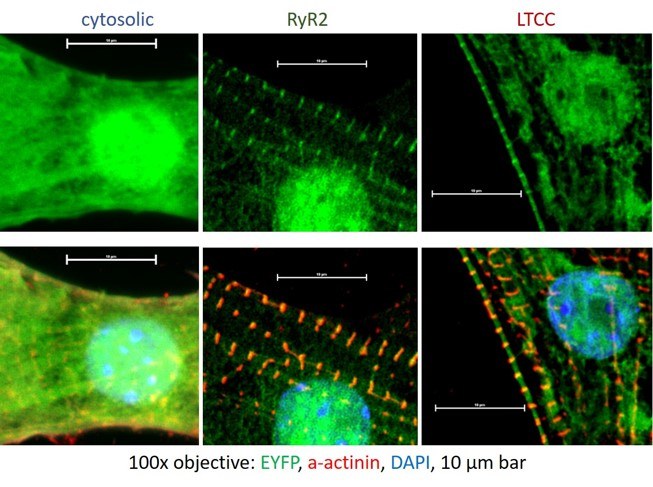
Gezielte Optogenetik
Subzelluläre Kontrolle der cAMP-Mikrodomänen-Signalübertragung in Kardiomyozyten durch gezielte Optogenetik
Optogenetik und optisches Voltage Mapping
Untersuchung der Auswirkungen des Ruhemembranpotenzials und der extrazellulären K⁺-Konzentration auf die Erregungsleitung des Herzens mit Hilfe von Optogenetik und optischem Voltage Mapping
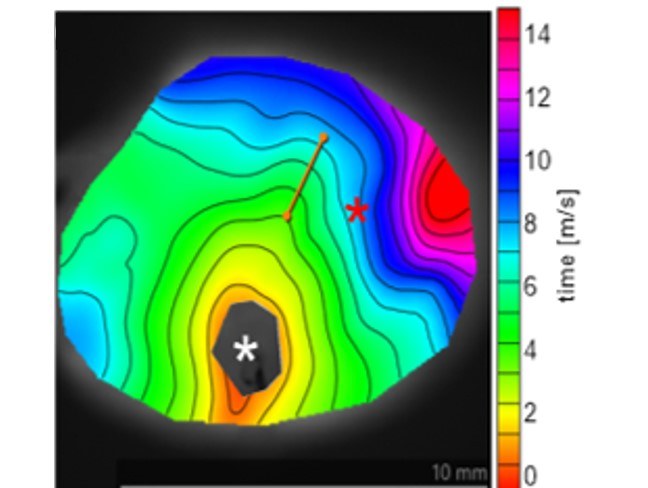
Optogenetische Quantifizierung der kardialen Erregbarkeit
Optogenetische Quantifizierung der kardialen Erregbarkeit und elektrischen Kopplung in intakten Herzen und ihre Konsequenzen für die Entstehung und Aufrechterhaltung von Herzrhythmusstörungen
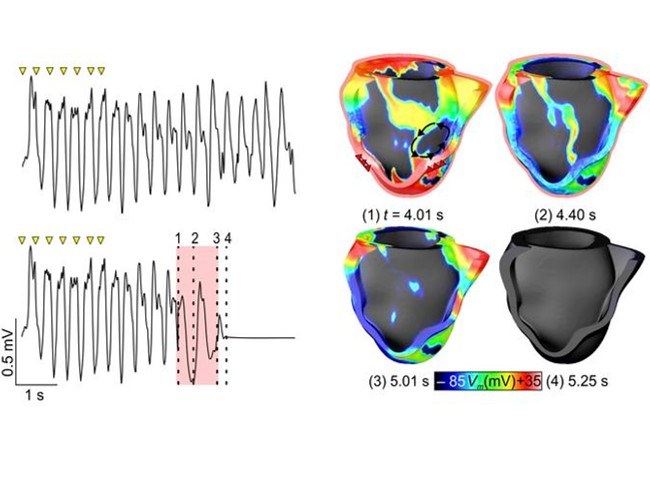
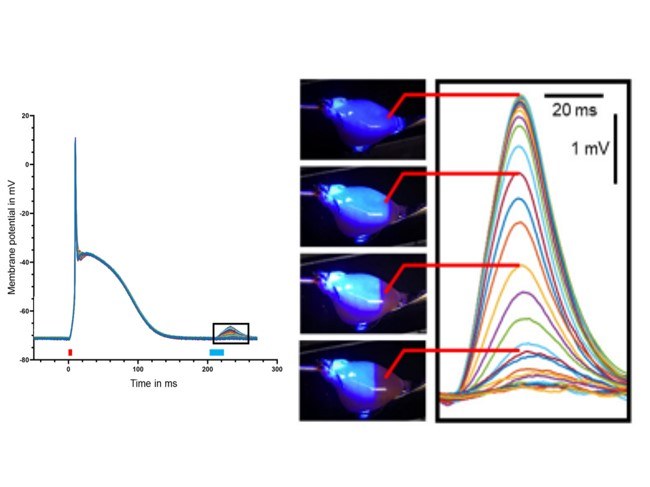
Optogenetisches Pacing und Defibrillation
Wellenlängenabhängige Lichttransmission der Herzwand, optogenetische Bestimmung der transmurale Kopplung und ihre Konsequenzen für optogenetisches Pacing und Defibrillation
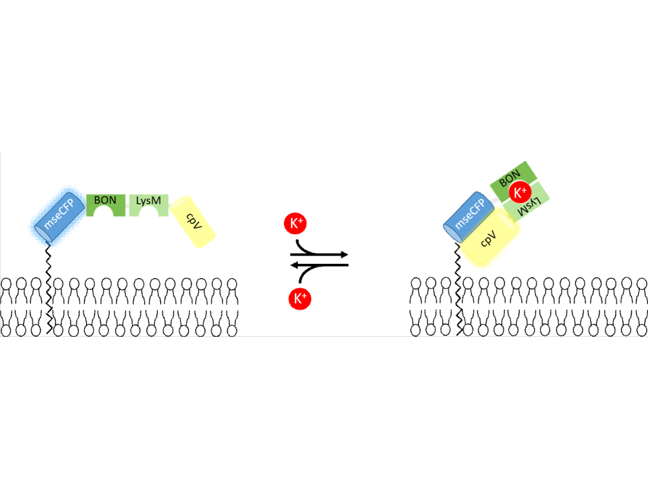
Extrazellulärer Kaliumionenindikator
Entwicklung eines genetisch kodierten extrazellulären Kaliumionenindikators

Rotverschobene Optogenetik
Enzymatische Vitamin A2-Produktion ermöglicht rotverschobene Optogenetik

Optogenetische G-Protein-gekoppelte Rezeptoren
Mitarbeiter*innen der AG Sasse
Kontakt und Anfahrt
Institut für Physiologie I
Nussallee 11
53115 Bonn

Wissenschaftliche Mitarbeitende / Postdoktorand*innen
Wanchana Jangsangthong
Dr. nat. med.
Technische Assistent*innen
Doktorand*innen
Alumni
Dr. med. Jakob Pantenburg
Milan Cokic
Dr. med. Susanne Rehnelt
Dr. med. Maximilian Funken
Dr. med. Philipp Makowka
Dr. med. Hendrik Lapp
Dr. rer. nat. Christopher Vogt
Prof. Dr rer. nat. Dr. med. Tobias Brügmann
Dr. med. Thomas Beiert
Dr. med. Thorsten Becker
Top-Publikationen
Optogenetic quantification of cardiac excitability and electrical coupling in intact hearts to explain cardiac arrhythmia initiation
Autoren: Judith S. Langen, Patrick M. Boyle, Daniela Malan, Philipp Sasse
Sci. Adv. 2025, 11. DOI:10.1126/sciadv.adt4103
Optogenetic stimulation of Gs-signaling in the heart with spatio-temporal precision
Autoren: Philipp Makowka, Tobias Bruegmann, Vanessa Dusend, Daniela Malan, Thomas Beiert, Michael Hesse, Bernd K. Fleischmann, Philipp Sasse
Nat. Commun. 2019, 10:1281. DOI: 10.1038/s41467-019-09322-7
Optogenetic termination of atrial fibrillation in mice
Autoren: Bruegmann T, Beiert T, Vogt CC, Schrickel JW, Sasse P.
Cardiovasc. Res. 2018, 114:713-723. DOI:10.1093/cvr/cvx250
Optogenetic defibrillation terminates ventricular arrhythmia in mouse hearts and human simulations
Autoren: Bruegmann T, Boyle PM, Vogt CC, Karathanos TV, Arevalo HJ, Fleischmann BK, Trayanova NA, Sasse P.
J. Clin. Invest.2016, 126:3894–3904. DOI: 10.1172/JCI88950
Human iPS Cell Model of Type 3 Long QT Syndrome Recapitulates Drug-Based Phenotype Correction
Autoren: Malan D, Zhang M, Stallmeyer B, Müller J, Fleischmann BK, Schulze-Bahr E, Sasse P*, Greber B*. (*:korrespondierende Autoren)
Basic Res. Cardiol. 2016, 111:14. DOI: 10.1007/s00395-016-0530-0

